Estrutura dos átomos
Um átomo é formado por um núcleo carregado positivamento rodeado por uma ou mais partículas carregadas negativamente, que recebem o nome de elétrons. As cargas positivas se igualam as negativas, de forma que o átomo não tem carga global, está eletricamente neutro. A maior parte da massa do átomo está no núcleo; a massa do elétrons é somente 1/1836 da massa do próton.
Mesmo o núcleo sendo mais pesado, ele é muito pequeno, em comparação com o tamanho global do átomo. Se um átomo fosse do tamanho da Terra, o nucleo teria somente 70 metros de diâmetro e se podia colocar facilmente em um pequeno estadio de futebol.
Ai vai um esqueminha: onde temos na primeira coloca a Partícula, na segunda a carga, e na terceira a massa..

O núcleo do átomo contém prótons e nêutrons; ambos tem massas quase iguais, porém se diferenciam em suas cargas. O nêutron não tem carga, enquanto que o próton tem carga positiva que neutraliza exatamente a carga negativa do elétron ( no esquema acima tem a carga de carga de cada um, assim como a sua respectiva massa)
Agora eu penso, tao simples, quando estamos aprendendo as coisas temos que aprender o que e um braco , uma perna, a cabeca, os ddedos, unhas.. aaaah. Agora um átomos tem que sabe o seguinte: Tem o nucleo que e formado por protons e neutrons, e ao redor tem os eletrosns, , como no centrto eles estao todos apertadinhos claro que sera menor a area ocupada, enquanto que os eletrons soa mais livres eles tem maior area pra passeas. se o proton e positivo, o eletron negativo e o neutron nao tem carga.. temos tambem a seguinte informacao. a quantidade de eletrons e a mesma que o pronto. entao temos um atomo neutro ao menos que percamos algum eletron
CARACTERÍSTICAS DO ÁTOMO
NÚMERO ATÔMICO
É o número que caracteriza o átomo, é representado pelo número de prótons. Por exemplo o oxigênio tem o número atômico 8, ou seja, ele tem 8 prótons.
NÚMERO DE MASSA (A)
O número de massa é representado pela letra A, e é equivalente ao número de prótons somado ao número de nêutrons

Observação: Número de massa não é o mesmo que massa atômica.
Isótopos
Relações atômicas
São átomos com o mesmo número atômico (Z)
Pensemos o seguinte se ele tem o mesmo número atômico, eles são o mesmo elemento, eles são o mesmo elemento, porém tem a quantidade de Nêutrons diferente, logo a sua massa é diferente pois:

Exemplo: Isótopos do elemento oxigênio: 8O16 8O17 8O18
Por volta de 450 a. C, o filosofolo grego Leucipo afirnou que a materia poderia ser dividida em particulas cada vez menores. A pergunta e: haveria um limite? Democrito, discipulo de Lecipo, defendeu a ideia do mestre e anunciou a sua conviccao de que a menor particula de qualquer classe de materia era indivisivel e denominou essa particula ATOMO ( que do grego significa "indivisivel") segundo Democrito as unicas coisas que existem sao os atomos e os espacos vazios entre eles.
- Modelo Atômico de Thomson (1898)


- Os Postulados de Niels Bohr (1885-1962)
 ....
....
Teoria Quântica
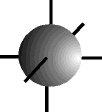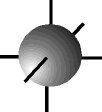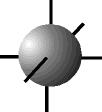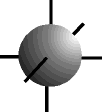
Com a descoberta dos prótons e elétrons, Thomson propôs um modelo de átomo no qual os elétrons e os prótons, estariam uniformemente distribuídos, garantindo o equilíbrio elétrico entre as cargas positiva dos prótons e negativa dos elétrons.

- Modelo Atômico de Rutherford (1911)
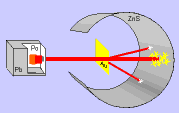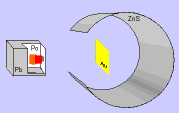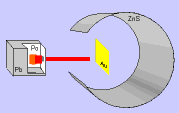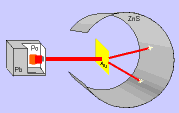
Rutherford bombardeou uma fina lâmina de ouro (0,0001 mm) com partículas "alfa" (núcleo de átomo de hélio: 2 prótons e 2 nêutrons), emitidas pelo "polônio" (Po), contido num bloco de chumbo (Pb), provido de uma abertura estreita, para dar passagem às partículas "alfa" por ele emitidas. Envolvendo a lâmina de ouro (Au), foi colocada uma tela protetora revestida de sulfeto de zinco (ZnS).

Observando as cintilações na tela de ZnS, Rutherford verificou que muitas partículas "alfa" atravessavam a lâmina de ouro, sem sofrerem desvio, e poucas partículas "alfa" sofriam desvio. Como as partículas "alfa" têm carga elétrica positiva, o desvio seria provocado por um choque com outra carga positiva, isto é, com o núcleo do átomo, constituído por prótons.
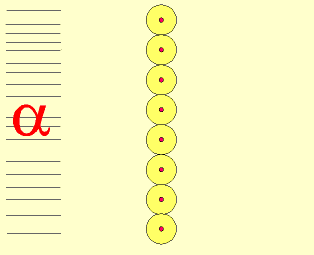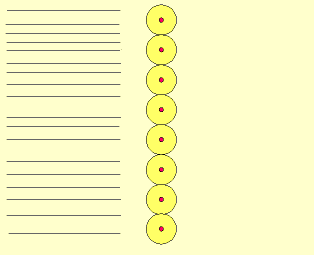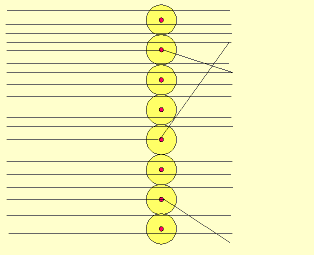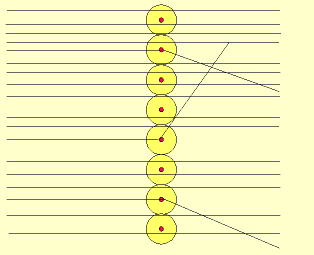
Assim, o átomo seria um imenso vazio, no qual o núcleo ocuparia uma pequena parte, enquanto que os elétrons o circundariam numa região negativa chamada de eletrosfera, modificando assim, o modelo atômico proposto por Thomson.

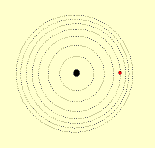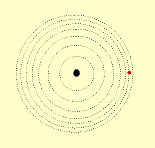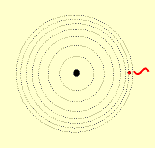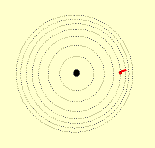
O modelo atomico de Bohr
Em 1913, o notavel fisico dinamarques Niels Bohr mostrou que as leis da fisica classica nao eram validas para os sistemas microscopicos, tais como o atomo e suas particulas constituentes. Bohr criou um novo modelo atomico fundamentado na teoria dos quanta de Max Planck, estabelecendo alguns postulados, entre os quais vamos citar agora:
- Os Postulados de Niels Bohr (1885-1962)
De acordo com o modelo atômico proposto por Rutherford, os elétrons ao girarem ao redor do núcleo, com o tempo perderiam energia, e se chocariam com o mesmo.
Como o átomo é uma estrutura estável, Niels Bohr formulou uma teoria (1913) sobre o movimento dos elétrons, fundamentado na Teoria Quântica da Radiação (1900) de Max Planck.
Como o átomo é uma estrutura estável, Niels Bohr formulou uma teoria (1913) sobre o movimento dos elétrons, fundamentado na Teoria Quântica da Radiação (1900) de Max Planck.
A teoria de Bohr fundamenta-se nos seguintes postulados:
1º postulado: Os elétrons descrevem órbitas circulares estacio-nárias ao redor do núcleo, sem emitirem nem absorverem energia.
1º postulado: Os elétrons descrevem órbitas circulares estacio-nárias ao redor do núcleo, sem emitirem nem absorverem energia.

2º postulado: Fornecendo energia (elétrica, térmica, ....) a um átomo, um ou mais elétrons a absorvem e saltam para níveis mais afastados do núcleo. Ao voltarem as suas órbitas originais, devolvem a energia recebida em forma de luz (fenômeno observado, tomando como exemplo, uma barra de ferro aquecida ao rubro).
 ....
....
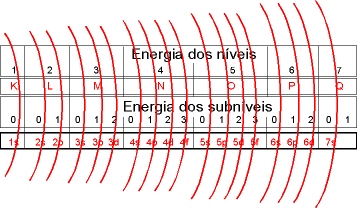
Bohr associou o espectro de emissao dos elementos com a eletrosfera de seus atomos. Notemos que os espectros de emissao dos atmos eram obtidos experimentalmente e com base nessas experiencias foi proposto o modelo de Bohr.
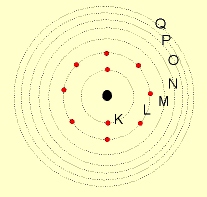
Os niveis de energia do atomos, tambem chamados camadas eletronicas, forma representados com letras K, L, M ..., que eram usadas para designar as raias dos espectros do raio X dos elementos. A cada nivel de energia foi atribuido um numero quantico principal, representado por n.
Teoria Quântica
De acordo com Max Planck (1900), quando uma partícula passa de uma situação de maior para outra de menor energia ou vice-versa, a energia é perdida ou recebida em "pacotes" que recebe o nome de quanta (quantum é o singular de quanta).
O quantum é o pacote fundamental de energia e é indivisível. Cada tipo de energia tem o seu quantum.
A Teoria Quântica permitiu a identificação dos elétrons de um determinado átomo, surgindo assim os "números quânticos".
O quantum é o pacote fundamental de energia e é indivisível. Cada tipo de energia tem o seu quantum.
A Teoria Quântica permitiu a identificação dos elétrons de um determinado átomo, surgindo assim os "números quânticos".
- Modelo Atômico de Sommerfeld (1916)
Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes (circulares e elípticas) a que denominou de subníveis, que podem ser de quatro tipos: s , p , d , f .

- Contribuição de Broglie
Em 1923, Louis Broglie mostrou, através de uma equação matemática, que "qualquer corpo em movimento estaria associado a um fenômeno ondulatório". Desta maneira o elétron apresenta a natureza de uma partícula-onda, obedecendo assim, às leis dos fenômenos ondulatórios, como acontece com a luz e o som.
- Teoria da Mecânica Ondulatória
- Teoria da Mecânica Ondulatória
Em 1926, Erwin Shröringer formulou uma teoria chamada de "Teoria da Mecânica Ondulatória" que determinou o conceito de "orbital" .
Orbital é a região do espaço ao redor do núcleo onde existe a máxima probalidade de se encontrar o elétron.
O orbital s possui forma esférica ...................
Orbital é a região do espaço ao redor do núcleo onde existe a máxima probalidade de se encontrar o elétron.
O orbital s possui forma esférica ...................

e os orbitais p possuem forma de halteres. ............